Ambiente da EM
No sistema imunitário do doente com esclerose múltipla, alguns linfócitos são autoreativos e promovem a inflamação do sistema nervoso central1-4.


Apoptose
Advém do grego, em que o prefixo "apo" significa "separação" e o sufixo "ptose" se traduz para "queda", sendo geralmente conhecida como a queda das folhas das árvores8.
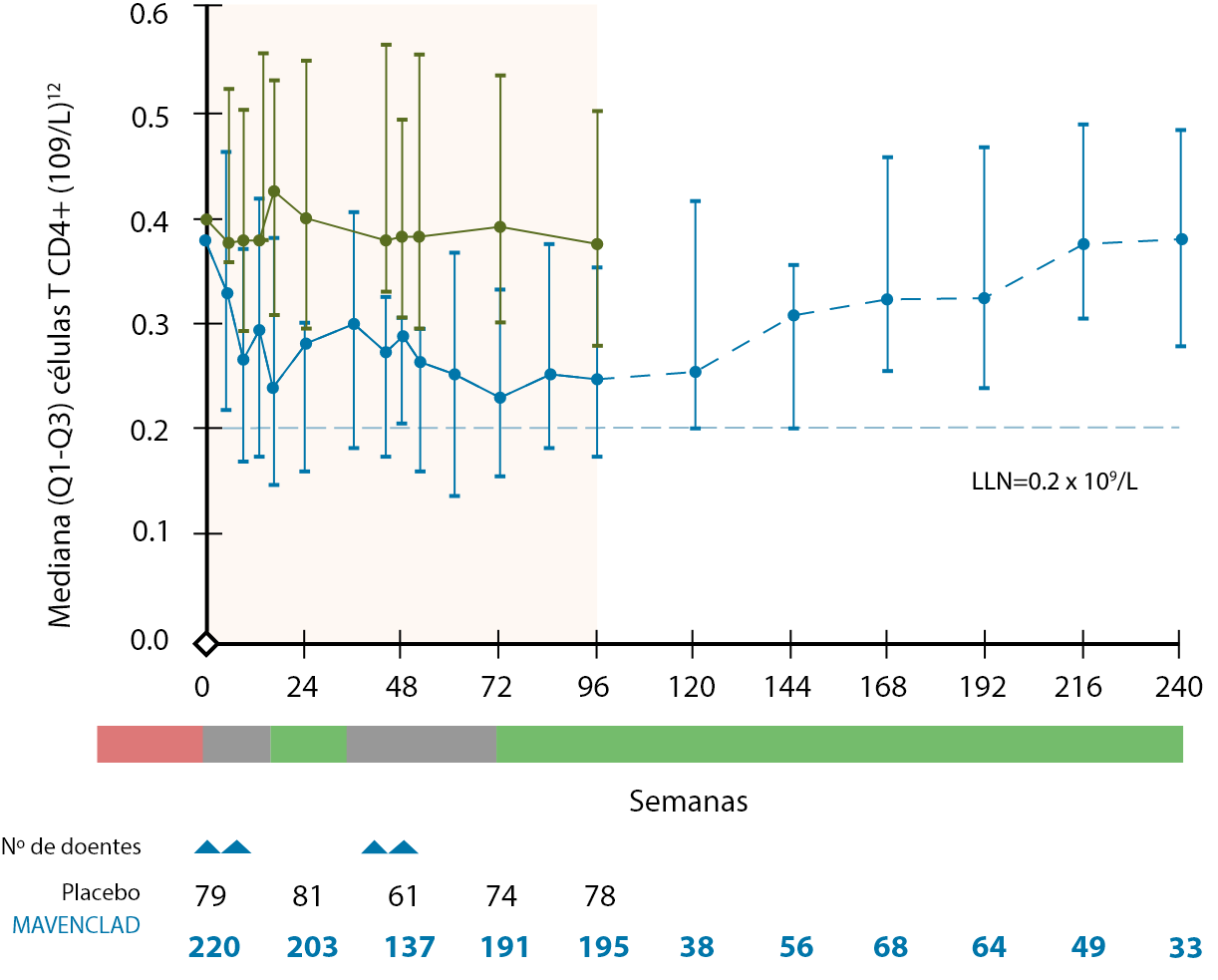
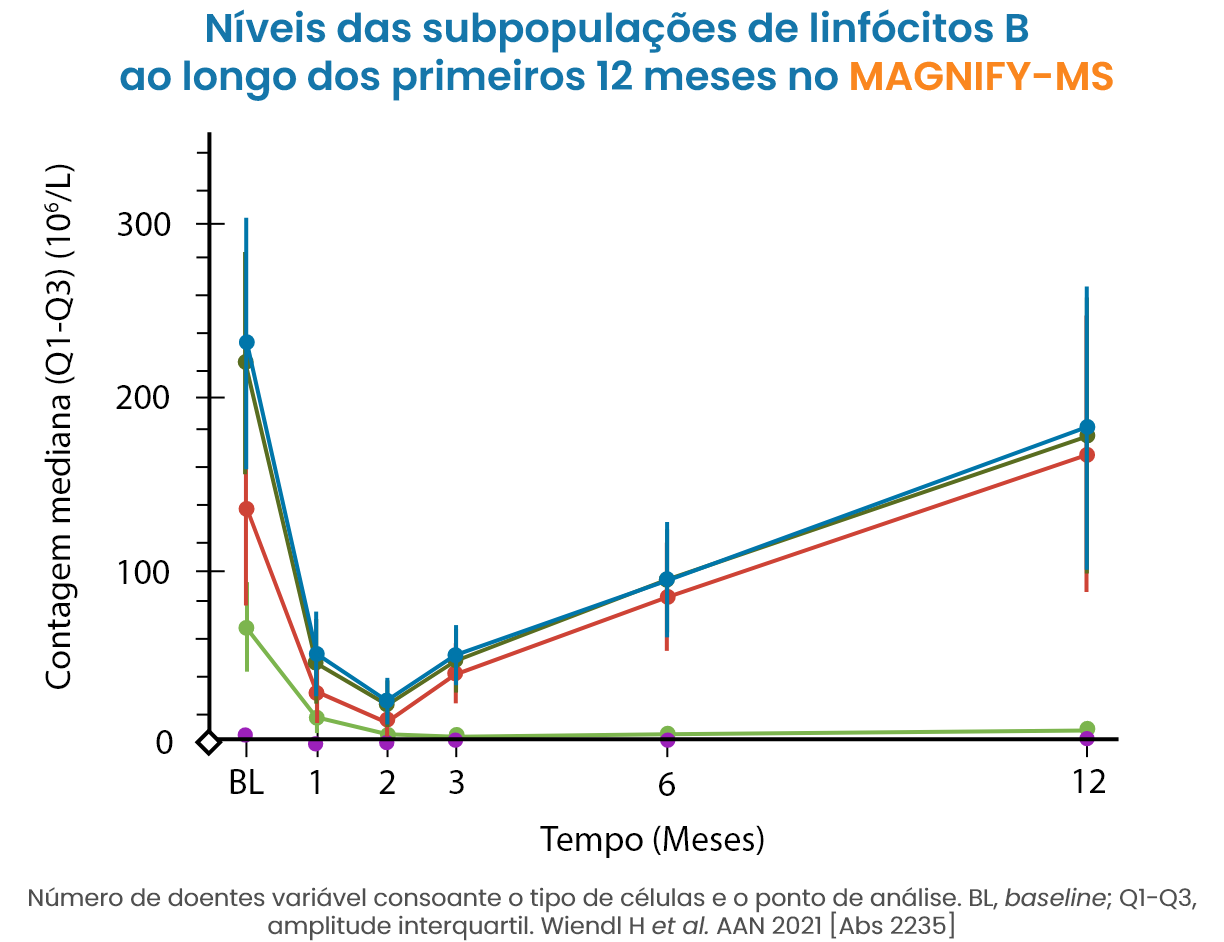
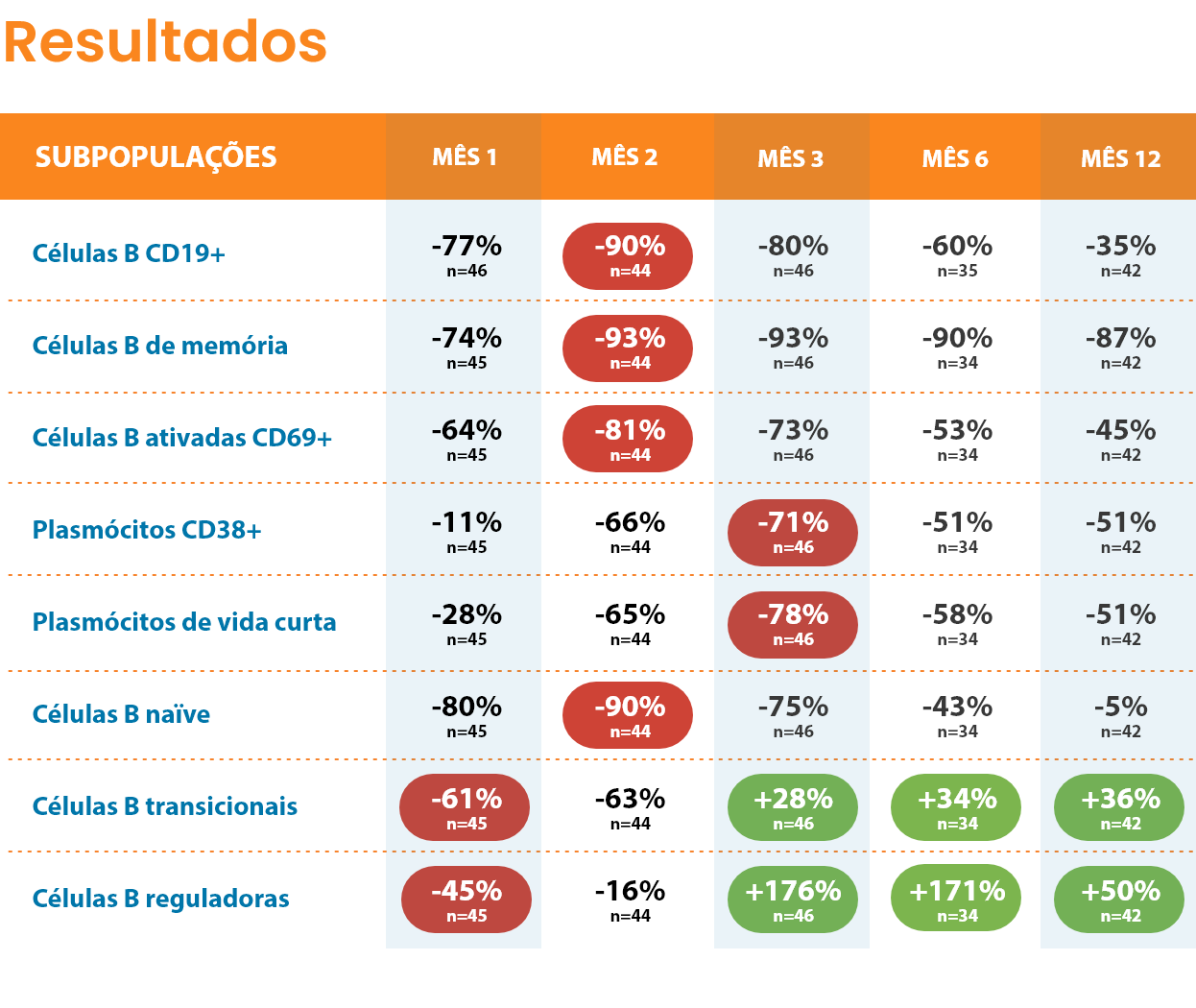
O tratamento com MAVENCLAD® promove uma depleção dos linfócitos por apoptose. Esta depleção é parcial e é transitória9,10 (ocorre durante os primeiros 2 meses após o inicio do tratamento11).


Reconstituição
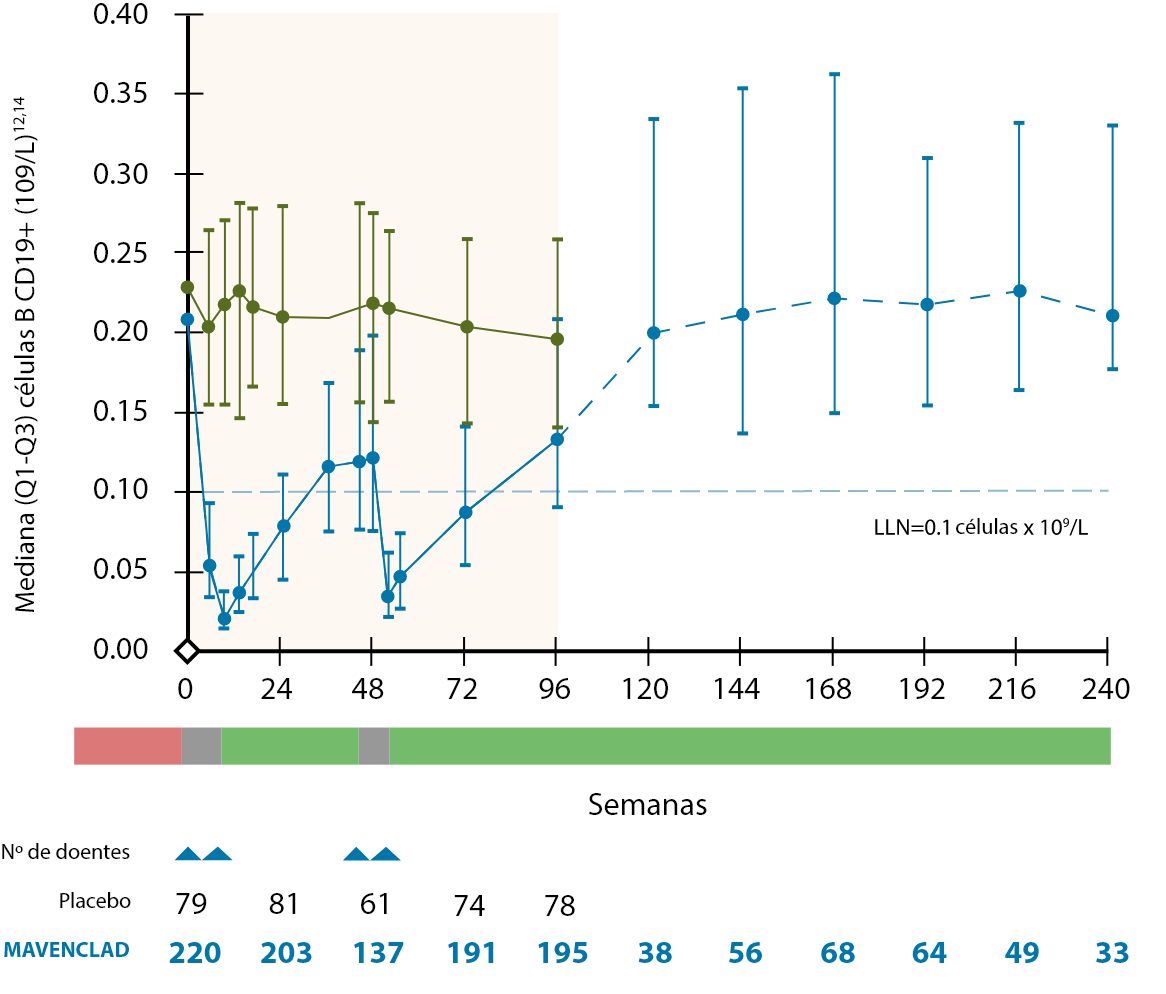
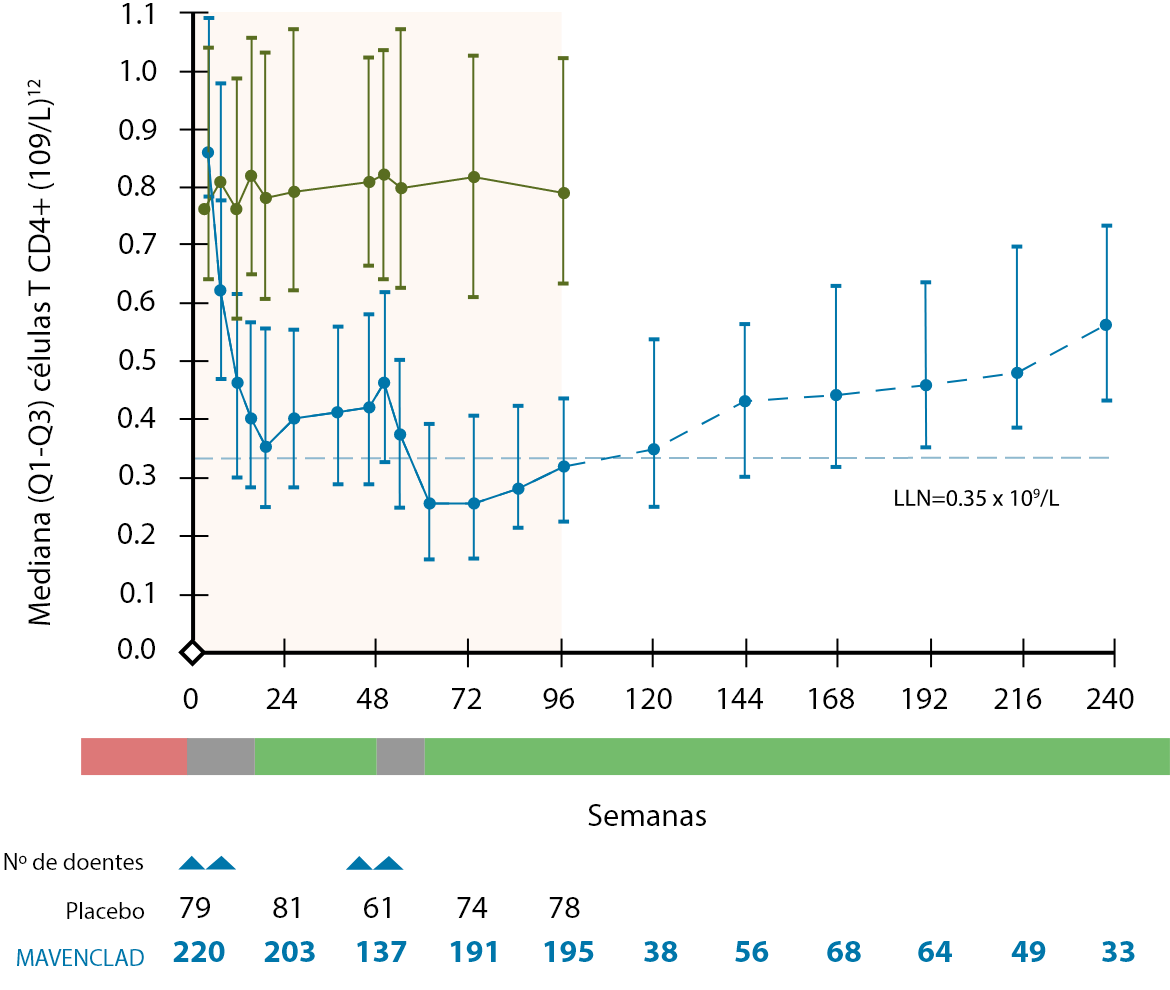
O tratamento com MAVENCLAD® não é de imunossupressão contínua, ocorrendo a reconstituição de linfócitos B e T após a sua depleção9,10. Nos estudos clínicos, as contagens linfocitárias medianas voltaram ao intervalo de valores normais no final de cada ano de tratamento12.




O mecanismo de ação proposto de MAVENCLAD® promove a repopulação das células linfocitárias após a sua depleção, contribuindo para a estabilização da doença através da terapia de reconstituição imunológica10,15